Dorothea Baltruksa, Maren Sowab, Maike Vossa,*
a) Centre for Planetary Health Policy, Berlin
b) Maren Sowa ist wissenschaftliche Mitarbeiterin und Doktorandin am Lehrstuhl für
Bürgerliches Recht, Medizin- und Gesundheitsrecht von Prof. Dr. Jens Prütting.
Dieser leitet als geschäftsführender Direktor das Institut für Medizinrecht an der Bucerius Law School
*Autor:innen in alphabetischer Reihenfolge
Wir bedanken uns für die freundliche Unterstützung bei Robert Schulz, Anja Leetz und Esther Luhmann.
Policy-Brief 01–2023
DOI: 10.5281/zenodo.7503601
Die Auswirkungen der Klimakrise auf unser Wohlergehen und unsere Gesundheit werden mit jeder Hitzewelle, jedem Extremwetterereignis und jeder Dürreperiode deutlicher. Doch auch andere durch menschliche Aktivitäten verursachte Umweltschäden haben direkte und indirekte Auswirkungen auf unsere Gesundheit. Vor allem der dramatische Biodiversitätsverlust sowie die Verschmutzung von Gewässern, Luft und Böden haben längst ein gefährliches Maß erreicht.1 Gesundheitsschutz ist also nicht nur in der Gesundheitspolitik anzusiedeln, ebenso wie Umweltschutz weit über die Umweltpolitik hinaus verbessert werden muss.
Das Arzneimittelwesen nimmt auf der einen Seite mit seinen wichtigen gesundheitsschützenden und ‑fördernden Produkten eine essenzielle Rolle in der gesundheitlichen Versorgung ein. Auf der anderen Seite trägt es durch seine chemikalienintensive Produktion erheblich zu Umwelt- und Klimabelastungen bei, die wiederum unserer Gesundheit und unseren Lebensgrundlagen schaden. In diesem Policy Brief stellen wir diese Problematik dar und zeigen auf, mit welchen rechtlichen Hebeln die Umwelt- und Klimabilanz des Sektors verbessert werden kann. Als besonders wirkungsvolle Hebel gilt eine zulassungsrelevante Umweltrisikoprüfung für Humanarzneimittel; die verpflichtende Berücksichtigung von Nachhaltigkeitskriterien in der Ausschreibung für Arzneimittel; die Einbeziehung von sowohl Treibhausgasemissionen als auch Auswirkungen auf die Biodiversität in das Lieferkettensorgfaltspflichtengesetz; transparente, zugängliche Daten zu den Klima- und Umweltauswirkungen von Neu- und Altarzneimitteln; die Reduktion von Verschwendung und unsachgemäßer Entsorgung; die Förderung von Generikaproduktion in Europa; sowie Aus- und Weiterbildungen für Pharmazeut:innen im Hinblick auf Umweltschutz und Nachhaltigkeit.
Umweltbilanz des Arzneimittelwesens
Etwa 5% der Treibhausgasemissionen Deutschlands entstehen im Gesundheitssektor.2 Eine genaue Erfassung der durch den Pharmasektor verursachten Beiträge fehlt jedoch bislang. Einen Orientierungswert bieten Berechnungen anderer Länder wie England oder Österreich, welche zeigen, dass pharmazeutische Produkte 20% der Emissionen im Gesundheitswesen ausmachen.3, 4 Global gesehen ist damit die pharmazeutische Industrie für mehr Emissionen verantwortlich als die Automobilindustrie.5 Während ein internationales Bündnis von Pharma- und Biotechkonzernen sich im November 2022 dafür aussprach, Emissionen in den Lieferketten als Teil eines „Activate program“ zu reduzieren, fokussieren sich konkrete Maßnahmen vorerst auf den Umstieg auf erneuerbare Energien in der Stromversorgung und umweltfreundlichere Transportwege.6 Die Beratungsfirma EcoAct berichtete 2021, dass 75% der börsennotierten biopharmazeutischen Unternehmen im gleichen Jahr ihre Scope 1 und Scope 2 Emissionen und 50% ihrer Scope 3 Emissionen (welche den Großteil der Emissionen in diesem Sektor ausmachen) in Einklang mit der Einhaltung des 1,5 Grad-Limits reduziert hatten (siehe Abbildung 1).7
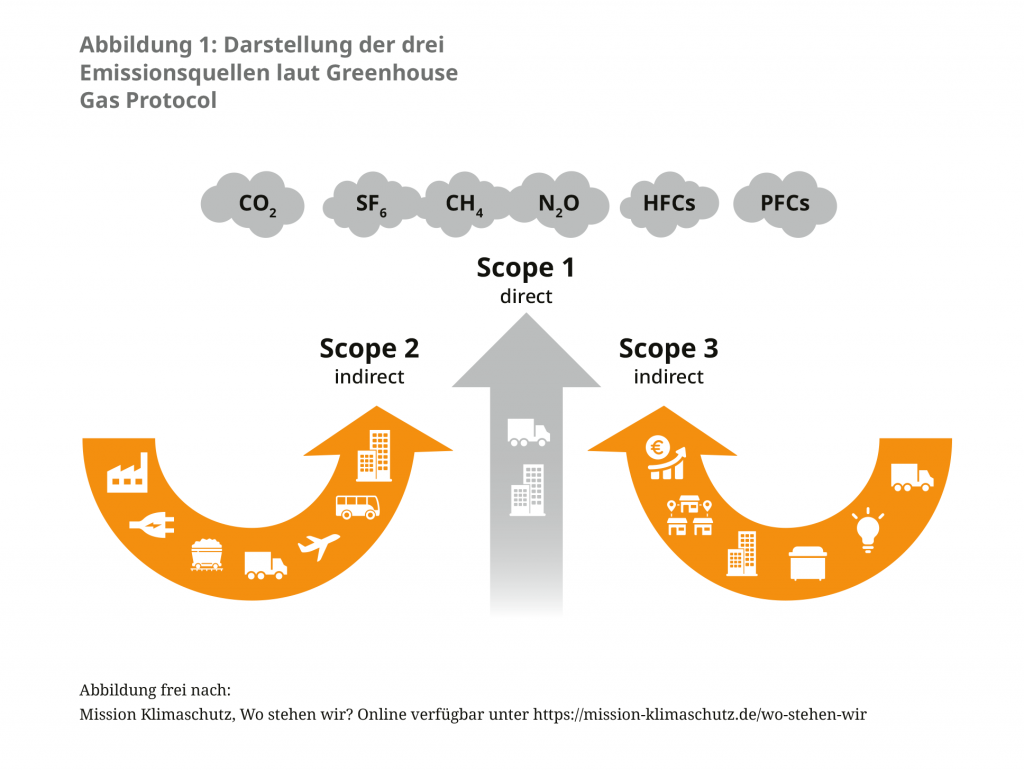
Neben den Treibhausgasemissionen wirken sich auch Arzneimittelrückstände – vor allem im Wasser – sowohl auf die menschliche Gesundheit als auch die Umwelt, beschrieben als Ökopharmakovigilanz, aus. Einer Analyse des Umweltbundesamtes (UBA) zufolge wurden im Jahr 2016 bereits 16 pharmazeutische Wirkstoffe im Oberflächen‑, Grund- und Trinkwasser aller Weltregionen nachgewiesen, allen voran das Schmerzmittel Diclophenac – dieses oft in ökotoxikologisch relevanten Konzentrationen.8 Insgesamt wurden in den untersuchten Regionen 631 Wirkstoffe gefunden. Dabei bilden die offiziellen Zahlen nur einen Teil der tatsächlichen Wasserverunreinigung ab, da in vielen Teilen der Welt keine ausreichenden Messdaten vorliegen. Auswirkungen auf die Umwelt entstehen dabei im gesamten Lebenszyklus eines Arzneimittels, von der Entwicklung, Produktion über die Lieferkette und die Verabreichung bis hin zur Entsorgung. Humanarzneimittel gelangen hauptsächlich durch die Ausscheidung sowie die unsachgemäße Entsorgung regelmäßig in die Umwelt. Zwar werden die daraus resultierenden Arzneimittelrück- stände im Wasser und in den Böden bislang nicht als gesundheitsgefährdend eingestuft, die Schäden für die betreffenden Ökosysteme sind jedoch erheblich und zum Teil noch nicht hinreichend erforscht.9
Beispielhafte Aktivitäten in anderen Ländern
In England erstellt der nationale Gesundheitsdienst (NHS) zur Erreichung der Klimaneutralität für seine Zuliefernden einen konkreten Zeitplan, der eine kontinuierliche Verschärfung der Berichts- und Emissionsreduktionspflichten von Herstellenden vorsieht, mit denen der NHS Verträge hat bzw. in Zukunft schließen will.10
Norwegen, Dänemark und Island integrierten erstmals Umweltkriterien im Rahmen der gemeinsamen Ausschreibung und Beschaffung von Arzneimitteln, der „Joint Nordic Tendering Procedure“, die 2022 in die zweite Runde ging. Dabei erhalten die Zuliefernden den Zuschlag, die Kriterien wie eine Umweltzertifizierung, eine Beschreibung von Umweltrichtlinien und ‑strategien oder einen umweltfreundlichen Transport umsetzen.11 Eine solche Einbeziehung von Umweltkriterien in Ausschreibungen ist in Deutschland zwar möglich, es gilt jedoch in erster Linie das Wirtschaftlichkeitsprinzipi.
Die Region Stockholm in Schweden entwickelte zwischen 2017 und 2021 eine „Wise List“ von Arzneimitteln, die Ärzt:innen dazu befähigt, bei gleichwertig wirksamen Produkten dasjenige auszuwählen, welches die geringsten umweltschädlichen Auswirkungen hat.12
Auch in den USA sind Umweltanalysen bei Medikamenten vorgeschrieben. Die Food and Drug Administration (FDA) bezieht Umweltauswirkungen bei der Zulassung neuer Medikamente ein und kann diese auch wieder entziehen, wenn neue Informationen zu Umweltschädigungen eines Medikaments bekannt werden. Risiken des bei der Produktion entstehenden Abwassers für gefährdete Tierarten und deren Lebensräume müssen auch außerhalb der USA geprüft werden.13
Aktuell bieten in Deutschland und in der Europäischen Union (EU) neue gesetzliche Initiativen und die derzeitige Überarbeitung von bestehendem Recht das Potenzial, die Regulierung von Umweltauswirkungen des Arzneimittelsektors zu verbessern.
i Nach dem im SGB V verankerten Wirtschaftlichkeitsprinzip dürfen die gesetzlichen Krankenkassen nur die Kosten für Leistungen übernehmen, die ausreichend, zweckmäßig und wirtschaftlich – also am kostengünstigsten – sind und das Maß des Notwendigen nicht überschreiten.
Green Pharmacy-Ansatz
Um Klimaneutralität zu erreichen und konsequenten Umweltschutz zu betreiben, braucht es jedoch einen allumspannenden „Green Pharmacy-Ansatz“.14 Dieser sieht u.a. vor,
- Umweltaspekte im gesamten Lebenszyklus von allen Medizinprodukten, also bereits im Forschungs- und Entwicklungsstadium sowie bei der Verschreibung und Entsorgung zu berücksichtigen.
- neue Substanzen zu bevorzugen, die bei gleicher Qualität und Wirksamkeit biologisch abbaubar sind und besser vom menschlichen Körper absorbiert werden, um Ausscheidungen in die Umwelt zu reduzieren.15
Derzeit geltende Regulierungen im deutschen Arzneimittelwesen
Bestrebungen nach mehr Nachhaltigkeit und Umweltschutz im Arzneimittelwesen gibt es bereits von vielen Akteur:innen der Branche. Arzneimittelhersteller:innen, Großhändler:innen, Apotheker:innen und zahlreiche weitere Beteiligte setzen nicht zuletzt durch internationale Verhaltenskodizes und Lieferant:innenverträge Nachhaltigkeitsziele in ihren Unternehmen um und engagieren sich damit bereits über das vorgegebene Maß hinaus. Um die Umwelt wirkungsvoll vor der andauernden Exposition von Arzneimitteln zu schützen, darf jedoch nicht allein auf freiwilliges Engagement gesetzt werden. Es bedarf vielmehr rechtlicher Rahmenbedingungen, die Innovationen zu mehr Nachhaltigkeit im Pharmaziesektor voran- treiben. Vor diesem Hintergrund lohnt sich ein Blick auf die derzeitige Rechtslage im Arzneimittelrecht, um Schwachstellen aufzudecken und Anknüpfungspunkte für die gesetzliche Verankerung von Nachhaltigkeit und Umweltschutz zu identifizieren.
Umweltschutz in der Neuzulassung: Ein zahnloser Tiger
Neben der erwünschten Wirkung haben pharmakologisch wirkende Stoffe häufig eine Umweltrelevanz.9 Daher sind bei der Beantragung einer Arzneimittelzulassung bei der Europäischen Arzneimittelagentur oder dem Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM)Unterlagen vorzulegen, anhand derer eine Bewertung möglicher Umweltrisiken vorgenommen wird.16 Diese Umweltverträglichkeitsprüfung sieht das Arzneimittelrecht für Tierarzneimittel seit 1998 und für Humanarzneimittel seit 2006 zwingend vor. Geprüft werden dabei mögliche unerwünschte Auswirkungen auf die Umwelt.17 Werden solch negative Umweltauswirkungen festgestellt, folgt daraus jedoch für Tierarzneimittel und Humanarzneimittel Unterschiedliches: Während die Zulassung eines Tierarzneimittels versagt werden kann, bleiben unerwünschte Umweltrisiken für die Zulassung von Humanarzneimitteln weitestgehend folgenlos.
Daher fließen negative Auswirkungen auf die Umwelt nicht in die für die Zulassung durchzuführende Nutzen-Risiko-Abwägung ein18 und Antragstellende haben bei ausgemachten Umweltrisiken bei der Zulassungsbeantragung lediglich Angaben zur Vermeidung dieser Gefahren beizufügen,19 etwa durch Hinweise in den Produktinformationen, jedoch ohne Konsequenz für die Zulassung des Arzneimittels. Inwiefern Anwendungs- und Entsorgungshinweise zum Zweck des Umweltschutzes in den Packungsbeilagen von Verbraucher:innen berücksichtigt werden, ist bisher nicht untersucht worden.
Als zuständige Behörde für die Umweltverträglichkeitsprüfung bei der Neuzulassung von Medikamenten fordert das UBA seit Jahren mehr Verbindlichkeit und Transparenz in der Regulierung von umweltrelevanten Auswirkungen der Arzneimittelindustrie. Konkret fordert das UBA, dass20
- die Umweltrisikoprüfung gestärkt und durch verpflichtende Risikomitigationsmaßnahmen ergänzt wird;
- die Umweltauswirkungen der pharmazeutischen Industrie in allen relevanten Regularien und Strategien in einem einheitlichen Rechtsrahmen geregelt werden;
- einheitliche Produktionsstandards inklusive Treibhausgasemissionsgrenzwerte, die von unabhängigen Inspektor:innen kontrolliert werden können, eingeführt werden.
Altarzneimittel ohne nachträgliche Umweltprüfung
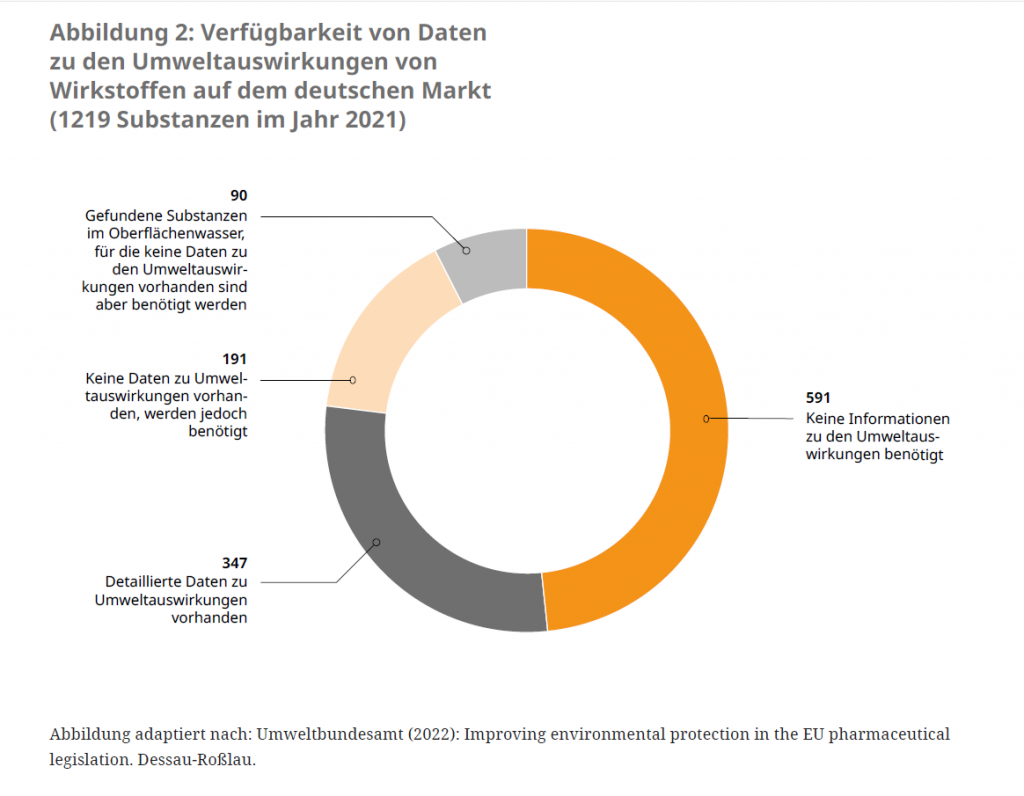
Neben der fehlenden Berücksichtigung von Umweltauswirkungen in der Neuzulassung mangelt es bei Pharmazeutika, die vor der obligatorischen Durchführung der Umweltverträglichkeitsprüfung 2006 zugelassen wurden, häufig an belastbaren Daten zur Umweltbilanz (siehe Abbildung 2). Diese „Altarzneimittel“ müssen keine nachträgliche Umweltverträglichkeitsprüfung durchlaufen. Zwar besteht bereits ein System zur Erfassung von Änderungen des Nutzen-Risiko-Verhältnisses,21 das sogenannte Pharmakovigilanz-System. Allerdings werden unerwünschte Umweltauswirkungen darin noch nicht erfasst.
Das ungenutzte Potential des Chemikalienrechts
Die aufgezeigten Lücken des Arzneimittelrechts werden zudem nicht durch andere Rechtsvorschriften geschlossen, um Umweltrisiken in rechtlichen Rahmenbedingungen zu berücksichtigen. Die REACH-Verordnungii schreibt zwar vor, dass Herstellende und Importierende von Chemikalien Umwelt- und Gesundheitsrisiken selbst bewerten und entsprechende Daten der Europäischen Chemikalienagentur bei Registrierung des chemischen Stoffes vorlegen müssen. Allerdings findet die Umweltprüfung auf Grundlage derREACH-Verordnung auf Pharmazeutika keine Anwendung. In Arzneimitteln enthaltene Stoffe sind von der Pflicht zur Registrierung und Stoffbewertung bisher ausdrücklich befreit.22
ii Die Verordnung (EG) 1907/2006 ist die Europäische Chemikalienverordnung zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe. „REACH“ steht für Registration, Evaluation, Authorisation and Restriction of Chemicals. Sie findet als verbindlicher, europäischer Rechtsakt in Deutschland unmittelbare Anwendung.
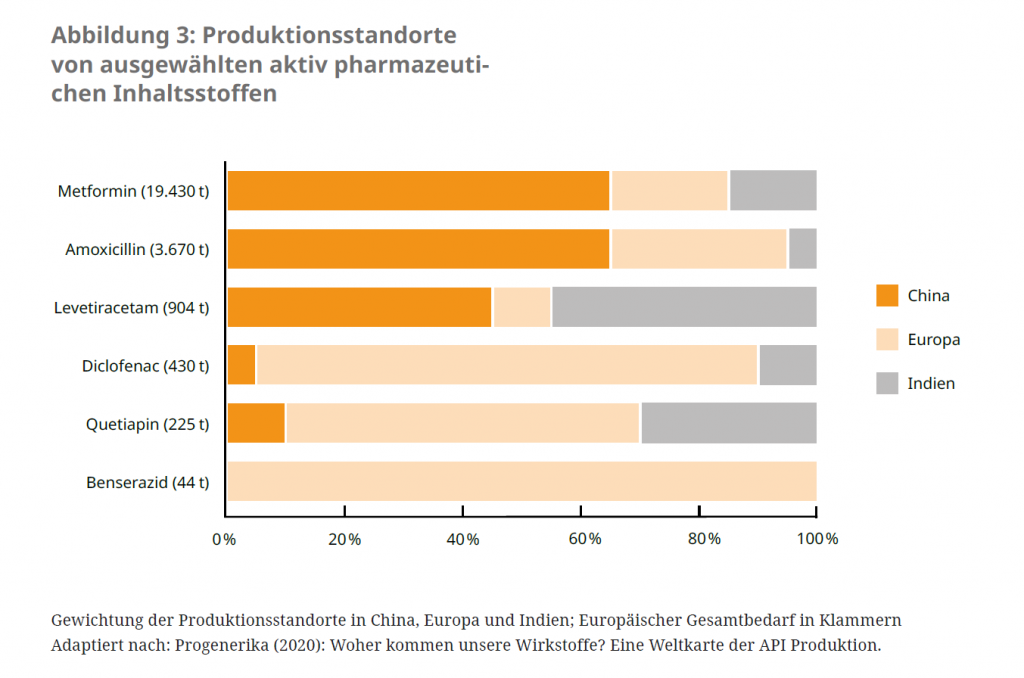
Strategische Abhängigkeit als Gesundheitsrisiko
Die Wirkstoffproduktion hat sich in den letzten 20 Jahren immer mehr auf wenige Regionen der Welt und auf eine kleine Anzahl von Herstellenden konzentriert.23 Insbesondere patentfreie Arzneimittel einschließlich vieler Antibiotika sowie Rohstoffe und Zwischenprodukte vieler Arzneimittel beziehen europäische Länder hauptsächlich aus China und Indien. Einige dieser internationalen Arzneimittellieferketten wurden durch die Covid-19-Pandemie unterbrochen. Die Europäische Kommission spricht daher von einer „strategischen Abhängigkeit“ von diesen für die öffentliche Gesundheit und die Versorgungssicherheit kritischen Produkten.24 Es wird daher angestrebt, die Versorgung mit kritischen Arzneimitteln durch eine Diversifizierung der Produktionsstandorte, einschließlich dem Wiederaufbau der Produktion innerhalb der EU, in Zukunft besser zu gewährleisten. Um Anreize dafür zu schaffen, bedarf es auch einer Neubetrachtung der Rabattverträge der Krankenkassen, da durch diese teilweise sehr geringe Preise für Generika gezahlt werden. Dieser Preisdruck hat dazu beigetragen, dass Hersteller die Produktionskosten auch durch Produktion in Drittstaaten so weit wie möglich gesenkt haben.25
Neben der Versorgungssicherheit bietet die Regulierung von Lieferketten im Arzneimittelwesen auch das Potenzial, die Einhaltung ökologischer und arbeitsrechtlicher Standards sowie den Schutz natürlicher Ressourcen zu verbessern. Das zum Januar 2023 in Kraft getretene Lieferkettensorgfaltspflichtengesetz (LkSG) hat das Potential, Arbeits- und Umweltstandards in pharmazeutischen Produktionsstätten und in der Lieferkette zu verbessern. Es betrifft zu- nächst (Pharma-)Unternehmen, die in der Regel mindestens 3.000 (ab 2024 dann 1.000) Arbeitnehmer:innen im deutschen Inland beschäftigen. Umweltauswirkungen werden durch das LkSG mittelbar erfasst, indem schädliche Bodenveränderungen, Gewässer- und Luftverschmutzungen menschenrechtliche Risiken darstellen können,26 wenn durch sie z.B. die natürlichen Grundlagen zur Nahrungsmittelproduktion oder die menschliche Gesundheit direkt geschädigt werden.iii Auswirkungen auf das Klima oder den Biodiversitätsverlust werden allerdings nicht berücksichtigt. Das LkSG mag damit ein erster Schritt in Richtung Umweltschutz in nationalen und internationalen Lieferketten sein. Nachbesserungsbedürftig ist es allerdings schon jetzt im Hinblick auf seine Reichweite: Bislang betrifft das Gesetz nur den eigenen Geschäftsbereich und unmittelbare Zuliefernde, wohingegen bei mittelbaren Zuliefernden lediglich eine anlassbezogene Risikoanalyse durch das Unternehmen durchzuführen ist. Eine Verletzung der Sorgfaltspflichten des LkSG begründet zudem keine eigene zivilrechtliche Haftung, vielmehr verbleibt die Rechtsdurchsetzung beim Bundesamt für Wirtschaft und Ausfuhrkontrolle (BAFA), welches Verstöße als Ordnungswidrigkeiten ahnden kann.
iii Eine unmittelbare Erfassung umweltbezogener Risiken – ohne konkreten Bezug zu menschen- rechtlichen Risiken – leistet das LkSG hinsichtlich der Vermeidung von langlebigen Schadstoffen (Stockholmer Übereinkommen), der Vermeidung von Quecksil- ber-Emissionen (Minamata-Kon- vention) sowie der Kontrolle der grenzüberschreitenden Verbrin- gung von gefährlichen Abfällen (Basler Übereinkommen).
Während das LkSG seinen Anwendungsbereich branchenunabhängig über die Zahl der Beschäftigten der Unternehmen definiert, legt der aktuelle Richtlinienentwurf der Europäischen Kommission darüber hinaus sogenannte „high-impact“-Sektoren fest, die typischerweise besonders sensibel für Verletzungen von Menschenrechts- und Umweltbelange sind.27 Aktuell fällt der pharmazeutische Sektor nicht unter die definierten Hochrisikosektoren. Für eine größere Reichweite der Lieferkettenregulierung wäre die Erweiterung um den Wirtschaftssektor Pharmazie bedeutsam.
Apotheken am Hebel für Gesundheit und Umweltschutz
Abgabestellen wie Apotheken haben großen Einfluss auf die bedarfsgerechte Verwendung und Entsorgung von Arzneimitteln und können somit die Eintragswege von Pharmazeutika in die Umwelt reduzieren. Hier spielen Apotheker:innen als direkte Kontaktpersonen der Endverbraucher:innen eine wesentliche Rolle. So ist es berufsrechtliche Pflicht der Apotheker:innen, die Patient:innen zu informieren und zu beraten,28 einschließlich sachgerechter Aufbewahrung und Entsorgung der Arzneimittel.29
Diese Beratungspflicht erstreckt sich jedoch nicht auf Hinweise über den umweltbewussten Umgang mit und die Entsorgung von Arzneimitteln mit Umweltrelevanz. Welchen Medikamenten aus Umweltgründen der Vorzug zu geben ist, könnte bei Beratungsgesprächen in Apotheken vermittelt werden. Grenzen der Beratung finden sich zunächst in der ärztlichen Therapiefreiheit, welche durch den Apotheker oder die Apothekerin nicht beeinflusst werden darf.30 Zum anderen setzt eine fachkundige Beratung über Umweltauswirkungen der Arzneimittel Vorwissen voraus, das durch Aus- und Weiterbildung sichergestellt werden müsste.
Einzelne medizinische Fachgesellschaften haben bereits Leitlinien erarbeitet, welche die Umweltbilanz verschiedener Medizinprodukte berücksichtigen. Dazu zählt beispielsweise die Handlungsempfehlung für die klimabewusste Verordnung von inhalativen Arzneimitteln von der Deutschen Gesellschaft für Allgemeinmedizin und Familienmedizin.31
Auch auf die Entsorgung könnte die Apotheke entscheidend Einfluss nehmen. Nach derzeitiger Rechtslage ist die Rücknahme von Medikamenten durch die Apotheke eine reine Serviceleistung. Eine Pflicht und ein damit einhergehender Anspruch der Kund:innen auf die Rücknahme der Medikamente besteht nicht. Bis zum Jahr 2009 bestand eine zentrale Regelung für die Entsorgung von Altmedikamenten über die Apotheken. Diese sinnvolle Regelung wurde infolge der Änderung der Verpackungsverordnung mit dem Wegfall eines für die Apotheken kostenlosen Abholsystems jedoch eingestellt.32 Eine neue, einheitliche Regelung könnte durch die EU-Abfallrahmenrichtlinie (2008/98/EG) erfolgen und zusammen mit zielgerichteter Aufklärung von Endverbraucher:innen über die sachgerechte Entsorgung von Arzneimitteln Wirkung entfalten.
Nachhaltiges Wirtschaften und Umweltschutz nimmt auch in der Apothekenlandschaft eine immer wichtigere Rolle ein. Anfang 2022 erwähnte die Bundesvereinigung Deutscher Apothekerverbände Nachhaltigkeit und Klimaschutz in der Präambel seines Beschlusses zur „Apotheke 2030“, führte diese Aspekte bisher aber nicht weiter aus.33 Im September 2022 war „Klimawandel, Pharmazie und Gesundheit“ die Schwerpunktthematik des Deutschen Apothekertages. Sieben relevante Anträge wurden angenommen, die sich mit Maßnahmen zur nachhaltigeren Arbeitsweise von Apotheken und der Bundesvereinigung Deutscher Apothekerverbände e.V. befassen und folgende Kernforderungen für den Berufsstand beinhalten:34
- Klimafreundliche Gestaltung der Arbeit in den Apotheken
- Integrierung der gesundheitlichen Folgen des Klimawandels in Aus‑, Fort- und Weiterbildung
- Beratung der Patient:innen zu gesundheitlichen Folgen des Klimawandels durch Apotheker:innen
- Einsatz der Berufsorganisationen der Apotheker:innen für umfassendere Klimaschutzmaßnahmen in Apotheken
Oft wird im Sektor jedoch darauf verwiesen, dass es einheitliche Regelungen auf EU-Ebene bräuchte, um Nachhaltigkeit rechtlich zu verankern.
Ansatzpunkte in neuen europäischen und deutschen Strategien
Den derzeit defizitären Regelungen im Arzneimittelrecht könnten aktuelle Reformbestrebungen der Europäischen Kommission Abhilfe verschaffen. Mit der Arzneimittelstrategie für Europa 2020 soll die Qualität und Sicherheit von Arzneimitteln gewährleistet sowie Transparenz und Sicherheit der Lieferketten erhöht werden. Ziel dieser Initiative ist ein Vorschlag für eine Verordnung, die insbesondere die geltenden EU- Arzneimittelvorschriften überarbeiten soll.35 In diesem Rahmen sollen die Anforderungen an die Umweltverträglichkeitsprüfung und die Verwendungsbedingungen für Arzneimittel gestärkt werden.
Neben der neuen Arzneimittelstrategie auf europäischer Ebene, liegt für Deutschland ein Regierungsentwurf für eine neue nationale Wasserstrategie vor. Diese sieht erhebliche Verbesserungen für die Kontrolle und die Reduktion von Schadstoffen in deutschen Gewässern vor. Mit ihr soll der Null-Schadstoff-Aktionsplan der EU sektorenübergreifend umgesetzt und das Chemikalienmanagement gestärkt werden. So sollen bis 2030 u.a. Schwellenwerte für Human- und Tierarzneimittel in der Grundwasserversorgung eingeführt und eine neue Datenbank für chemische Stoffe etabliert werden, die Transparenz schafft und Nachsteuerung ermöglicht.36
Um Umwelt- und Klimaschutz im Arzneimittelwesen wirkungsvoll zu etablieren, eröffnen sich, wie in diesem Policy Brief dargelegt, mehrere Handlungsfenster für Gesetzgebende auf Bundes- und EU-Ebene, sowie für Akteur:innen des Arzneimittelsektors.
Handlungsempfehlungen für Gesetzgebende auf Bundes- und EU-Ebene und den Arzneimittelsektor
Um Nachhaltigkeit und Klimaschutz angesichts der Dringlichkeit der ökologischen Krisen im gesamten Arzneimittelsektor zu verbessern, bieten sich Gesetzgebenden folgende Handlungsoptionen:
- Zulassungsrelevante Umweltrisikoprüfung für alle Humanarzneimittel mit verbindlichen Risikoreduktionsmaßnahmen im Arzneimittelrecht auf nationaler und europäischer Ebene: Im Zusammenspiel von Chemikalien- und Arzneimittelrecht braucht es die Einbeziehung von Umweltauswirkungen in das Zulassungsregime von Humanarzneimitteln oder ihrer Wirkstoffe in der europäischen Richtlinie 2001/83/EG (Gemeinschaftskodex für Humanarzneimittel) und im deutschen Arzneimittelgesetz.
- Verpflichtende Berücksichtigung von Nachhaltigkeitskriterien in der Ausschreibung für Arzneimittel: Hierzu sollte Nachhaltigkeit im SGB V vom Gesetzgeber verankert werden.
- Einbeziehung von Treibhausgasemissionen und Auswirkungen auf Biodiversität in das Lieferkettensorgfaltspflichtengesetz: Das Gesetz sollte um diese essenziellen Dimensionen erweitert und mit klaren, evidenzbasierten Kriterien versehen werden.
- Transparente, öffentlich zugängliche Daten zu den Klima- und Umweltauswirkungen von Neu- und Altarzneimitteln: Diese Daten sollten öffentlich zugänglich sein und evidenzbasierte Schwellenwerte festgelegt werden, um Schäden in Ökosystemen zu begrenzen.
- Reduktion von Verschwendung und unsachgemäßer Entsorgung: Eine bessere Aufklärung von Apotheker:innen durch die Berufsverbände und Hersteller, Gesundheitsfachpersonal und Patient:innen über die sachgemäße Entsorgung von Arzneimitteln sowie eine Ausweitung von Rücknahmestellen für Arzneimittel in Apotheken ist wünschenswert.
- Förderung von Generikaproduktion in Europa: Um Versorgungssicherheit insbesondere mit Antibiotika in Deutschland zu gewährleisten, transparente Informationen und Kontrolle über die Produktionsbedingungen zu haben sowie Emissionen zu sparen, sollten strengere Vorgaben in Bezug auf Rabattverträge für Generika beschlossen und/oder die Generikaproduktion in Europa gezielt gefördert werden.
- Aus- und Weiterbildungen für Pharmazeut:innen im Hinblick auf Umweltschutz und Nachhaltigkeit: Sowohl Studierende der Pharmazie als auch bereits examinierte Apotheker:innen sollten im Umgang mit umweltgefährdenden Arzneimitteln geschult werden. Zudem müssen Umweltrisiken von Arzneimitteln dringend öffentlich zugänglicher und sichtbar gemacht werden, damit sich Apotheker:innen über Veränderungen der Umweltrisiken informieren können.
Um Gesundheit, Klima und Umwelt zu schützen, sollten diese Handlungsmöglichkeiten in der Regulierung des Arzneimittelsektors schnellstmöglich auf bundespolitischer bzw. EU-Ebene umgesetzt werden. Auch Akteur:innen in der Pharmazie spielen eine wichtige Rolle und sollten ihre Verantwortung sowie ihre Handlungsmöglichkeiten stärker wahrnehmen.
Literatur
- Wissenschaftlicher Beirat der Bundesregierung Globale Umweltveränderungen (WBGU) (2021). Planetare Gesundheit: Worüber wir jetzt reden müssen.
https://www.wbgu.de/fileadmin/user_upload/wbgu/publikationen/factsheets/fs10_2021/wbgu_ip_2021_ planetare_gesundheit.pdf - Health Care Without Harm (2019). Health care’s climate footprint.
https://noharm-global.org/sites/default/files/documents-files/5961/HealthCaresClimateFootprint_092319.pdf - NHS England (2022). Delivering a ‘Net Zero’ National Health Service.
- Weisz, U. et al. (2019). Der Carbon Fußabdruck des österreichischen Gesundheitssektors. Endbericht. Klima- undEnergiefonds. Austrian Climate Research Programme.
- Belkhir, L., Elmeligi, A. (2019). Carbon footprint of the global pharmaceutical industry and relative impact of its major players. Journal of Cleaner Production, 214, 185–194.
- Manufacture 2030 (2022). Activate program launched to accelerate decarbonization in active pharmaceuticalingredient (API) supply chains.
https://manufacture2030.com/insights/news/2022/11/activate-program-launched-to-accelerate-decarbonization-in-active-pharmaceutical-ingredient-api-supply-chains - EcoAct (2021). The Climate Reportung and Performance of the DOW 30, EURO STOXX 50 and FTSE 100.
https://info.eco-act.com/hubfs/0%20-%20Downloads/SRP%20research%202021/Climate-reporting- performance-research-2021.pdf?hsLang=en - Aus der Beek, T. et al. (2016). Pharmaceuticals in the envrionment: Global occurance and potential cooperative action under the Strategic Approach to International Chemicals Management (SAICM). Umweltbundesamt.
- Umweltbundesamt (2014). Arzneimittel in der Umwelt.
- NHS England (o.D.). Net zero supplier roadmap.
https://www.england.nhs.uk/greenernhs/get-involved/suppliers/ - 11 Amgros (2022). Second Joint Nordic Tendering Procedure for medicines complete.
https://amgros.dk/en/knowledge-and-analyses/articles/second-joint-nordic-tendering-procedure-for- medicines-completed/ - Region Stockholm (o.D.). Informationen zu Umweltwirkungen von Arzneimitteln.
https://janusinfo.se/beslutsstod/lakemedelochmiljo.4.72866553160e98a7ddf1d01.html - Walter, S., Mitkidis, K. (2018). The Risk Assessment of Pharmaceuticals in the Environment: EU and US Regulatory Approach. European Journal of Risk Regulation, 9 (3), 527–547.
- Daughton, C.G. (2003). Cradle-to-cradle stewardship of drugs for minimizing their environmental disposition while promoting human health. I. Rationale for and avenues toward a green pharmacy. Environmental Health Perspectives, 111 (5).
- Kümmerer, K., Hempel, M. (2010). Green and sustainable pharmacy.
- Arzneimittelgesetz (2012). § 22 Zulassungsunterlagen Abschnitt 3c.
https://www.gesetze-im-internet.de/amg_1976/__22.html - Krüger, C. in Kügel, J.W., Müller, R.-G., Hofmann, H.-P. (2022). Arzneimittelgesetz (Beck’sche Kurz- Kommentare). C.H.Beck Verlag.
- Arzneimittelgesetz (2012). § 4 Sonstige Begriffsbestimmungen Abschnitt 28.
https://www.gesetze-im-internet.de/amg_1976/__22.html - Arzneimittelgesetz (2012). § 22 Zulassungsunterlagen Abschnitt 3c.
https://www.gesetze-im-internet.de/amg_1976/__22.html - Gildemeister, D. et al. (2022). Improving environmental protection in EU pharmaceutival legislation. Umweltbundesamt.
- Arzneimittelgesetz (2012). § 63b Allgemeine Pharmakovigilanz-Pflichten des Inhabers der Zulassung.
https://www.gesetze-im-internet.de/amg_1976/__22.html - Richtlinie 2006/121/EG des Europäischen Parlaments und des Rates zur Angleichung der Rechts- und Verwaltungsvorschriften für die Einstufung, Verpackung und Kennzeichnung gefährlicher Stoffe im Hinblick auf ihre Anpassung an die Verordnung (EG) Nr. 1907/2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) und zur Schaffung eines Europäischen Amtes für chemische Stoffe. II: Registrierung von Stoffen, Abschnitt 5 lit. A.
https://eur-lex.europa.eu/legal-content/DE/TXT/PDF/?uri=CELEX:32006L0121&from=EN - Progenerika (2020). Woher kommen unsere Wirkstoffe? Eine Weltkarte der API Produktion.
- Europäische Kommission (2021). Mitteilung der Kommission an das Europäische Parlament und den Rat:Strategische Vorausschau 2021 – Die Handlungsfähigkeit und Handlungsfreiheit der EU.
- Bundesverband der pharmazeutischen Industrie e.V. (2022). Produktion von Arzneimitteln.
https://www.bpi.de/de/themendienste/produktion-von-arzneimitteln - Gesetz über die unternehmerischen Sorgfaltspflichten zur Vermeidung von Menschenrechtsverletzungen in Lieferketten (2022). § 2 Begriffsbestimmungen, Abschnitt 2, Nummer 9.
https://www.gesetze-im-internet.de/lksg/__2.html - Europäische Kommission (2022). Vorschlag für eine Richtlinie des Europäischen Parlaments und des Rates über die Sorgfaltspflichten von Unternehmen im Hinblick auf Nachhaltigkeit und zur Änderung der Richtlinie (EU) 2019/1937.
- Verordnung über den Betrieb von Apotheken (Apothekenbetriebsordnung — ApBetrO) (2012). § 20 Information und Beratung, Abschnitt 1.
https://www.gesetze-im-internet.de/apobetro_1987/inhalts_bersicht.html - Verordnung über den Betrieb von Apotheken (Apothekenbetriebsordnung — ApBetrO) (2012). § 20 Information und Beratung, Abschnitt 2.
https://www.gesetze-im-internet.de/apobetro_1987/inhalts_bersicht.html - Verordnung über den Betrieb von Apotheken (Apothekenbetriebsordnung — ApBetrO) (2012). § 20 Information und Beratung, Abschnitt 1a.
https://www.gesetze-im-internet.de/apobetro_1987/inhalts_bersicht.html - Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM) (2022). Klimabewusste Verordnung von inhalativen Arzneimitteln.
- Wessinger, B. (2018). Altarzneimittel gehören in die Apotheke!
https://www.deutsche-apotheker-zeitung.de/news/artikel/2018/03/22/altarzneimittel-gehoeren-in-die– apotheke - Bundesvereinigung Deutscher Apothekerverbände e.V. (2022). Apotheke 2030: Perspektiven zur pharmazeutischen versorgung in Deutschland (2.0).
- ABDA (2022). Beschlüsse der Hauptversammlung der deutschen Apothekerinnen und Apotheker.
https://www.abda.de/fileadmin/user_upload/assets/DAT_Beschluesse/DAT_2022_Beschluesse.pdf - European Commission (2020). Pharmaceutical Strategy for Europe.
- Bundesministerium für Umwelt, Naturschutz, nukleare Sicherheit und Verbraucherschutz (2022). Regierungsentwurf Nationale Wasserstrategie.
https://www.bmuv.de/download/regierungsentwurf-nationale-wasserstrategie
© CPHP, 2022
Alle Rechte vorbehalten.
Centre for Planetary Health Policy
Cuvrystr. 1, 10997 Berlin
info@cphp-berlin.de
www.cphp-berlin.de
Zitationsvorschlag:
Baltruks D., Sowa M., Voss M. (2023). Nachhaltigkeit im Arzneimittelwesen stärken. Policy Brief 01–2023. Berlin: Centre for Planetary Health Policy. Abrufbar unter: www.cphp-berlin.de
CPHP-Publikationen unterliegen einem dreistufigen internen Überprüfungsverfahren und geben die Auffassung der Autor:innen wieder.
Disclaimer:
Author:innen in alphabetischer Reihenfolge.
Kontakt: Maike Voss maike.voss@cphp-berlin.de
